پی اچ یا پ هاش (به انگلیسی: pH، مخفف potential of Hydrogen) یک کمیت لگاریتمی است که میزان اسیدی یا بازی بودن مواد را مشخص میکند. بیشتر آبزیان فقط در پیاچ بین 9-5 زنده میمانند.

بررسی غلظت یون هیدروژن در اواخر سده 19 برای برخی از صاحبان صنایع شیمیایی اهمیت ویژهای پیدا کرد.
بعنوان مثال غلظت یون هیدروژن در طول فرایند تخمیر و فعالیت مخمرها اثر میگذارد و لازم است که غلظت یون هیدروژن دایماً مورد بررسی قرار گیرد.
از طرفی چون غلظت یون هیدروژن معمولاً عددی بسیار کوچک است و کار کردن با آن دشوار است، نخستین بار سورِن سِن دانشمند دانمارکی در سال 1909 میلادی مقیاسی به نام pH را بنا کرد. بنا به تعریف، pH برابر منفی لگاریتم مبنای 10 غلظت مولی یون هیدروژن فعال در محلول است.
در دمای اتاق (pH (298K آب خالص را 7 در نظر میگیریم. زیرا در این دما غلظت یون هیدرونیم در آب خالص برابر 10-7 است.
در دمای اتاق (298K) گسترهٔ بازهٔ pH از (14~0) است. عدد 0 اسیدیترین محیط و عدد 14 بازیترین محیط را مشخص میکند. در چنین دمایی، محلولی با pH = 7 خنثی در نظر گرفته میشود.
با بالا بردن دما، گسترهٔ بازهٔ pH کمتر میشود. برای مثال در دمای 358K این بازه به (13~0) تغییر میکند. در نتیجه در چنین دمایی، محلولی با pH=6.5 را خنثی فرض خواهیم کرد.
معمولا بهترين درجه pH براي گياهان در روش هيدروپونيک بين 5.5 الی 7 میباشد، كه البته بستگی به نوع گياه نيز دارد. براي تنظيم pH از جمله کاهش آن از اسيد سولفوريک، اسيد كلريدريک و يا اسيد فسفريک و برای افزايش آن از هيدروکسيد کلسيم و يا هيدروكسيد سديم ميتوان استفاده نمود.
تقریبا تمامی آب دریاها pH قلیایی دارند و در pH کمتر از 5 تمام ماهیها تلف میشوند. پس آبهای اطراف ما طوری هستند که آبزیان بتوانند در آن زندگی کنند نه آنطور که ما میخواهیم!
در شکل زیر نوار سبز رنگ، بهترین درجه اسیدیته برای بالاترین میزان جذب عناصر در اغلب گیاهان را نشان میدهد:
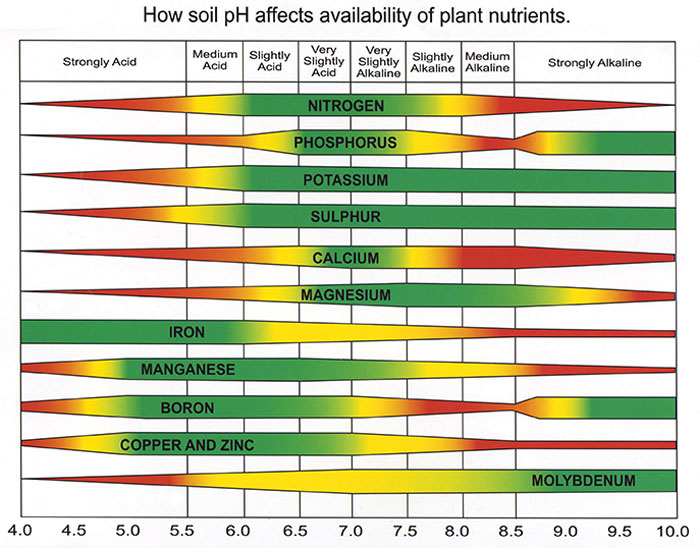
در هنگام تنظيم pH با هر نوع اسيد يا قليا، بايد به عناصری كه از اين طريق به محلول غذايی اضافه میشود توجه داشت و آن را در فرمول اصلی ساخت محلول، لحاظ نمود.
زمان اندازهگيری و تنظيم pH بسته به نوع سيستم كشت و نيز نوع محلول متفاوت بوده و نبايد از آن غفلت نمود. زيرا تغيير بيش از حد آن موجب عدم توازن در جذب عناصر و در نتيجه آسيب رسيدن به گياه و يا محصول آن میگردد كه حتی ممكن است غير قابل جبران بوده و موجب مرگ گياه گردد.
در تصویر زیر نمونهای از درجه اسیدیته (pH) مواد مختلف را میبینید:

شناساگرها (Indicators)
شناساگرها در محیطهای اسیدی یا بازی به رنگهای متفاوتی درمیآیند. از شناساگرها برای تعیین pH محلولها استفاده میشود.
از جمله شناساگرهای معروف میتوان به موارد زیر اشاره کرد:
1- گلبرگ گل سرخ
2- کاغذ تورنسل (لیتموس) که از درخت لیتموس به دست میآید.
3- محلول فنول فتالئین (که اگر در یک محلول بازی ریخته شود به سرعت رنگ محلول را ارغوانی میکند)
4- محلول متیل اورانژ (متیل نارنجی)
5- محلول متیلن بلو
استفاده از شناساگرهای شیمیایی وقت گیر و همراه با اشتباه در تعیین دقیق pH است؛ از این رو امروزه از pH سنج دیجیتالی استفاده میشود.

از نظر سمپاشی آب قلیایی بهتر است یا اسیدی؟
اینکه آب قلیایی یا آب اسیدی برای سمپاشی خوب است بستگی به ساختار شیمیایی آن مولکول دارد و نمیتوان یک دستورالعمل کلی ارائه کرد. در شاخص پایداری سموم، آیتمی داریم به نام KT50 که در واقع نیمه عمر آن سم یا مولکول میباشد.
بعضی از سموم قلیا دوست و بعضی اسید دوست هستند. اصلاح کنندههای آب معمولا طوری طراحی میشوند که همزمان با کاهش پی اچ، مقدار کربنات و بیکربنات را نیز کاهش دهند. پس باید با توجه با نیمه عمر سم، pH مناسب را بیابید. این مسئله بزرگترین هنر یک کارشناس مبارزه با آفات خواهد بود. حتما در این مورد با یک شیمیست مجرب مشاوره کنید.
برخلاف تصور عمومی که فکر میکنند علف کشها، pH اسیدی دوست دارند، تری بنورون اینگونه نیست. نیمه عمر آن در pH=5 ، کمتر از یک روز؛ در pH=7، بیش از 15 روز و در pH=9 ، کاملا پایدار است. پس برای اینکه مولکول تجزیه نشود و دست نخورده به رسپتور برسد باید در محیط قلیایی باشد.
سولفوسولفورون بالاترین پایداری را در محدوده خنثی دارد. البته به محیط قلیایی بیشتر متمایل است. تقریبا هیچ کسی یا هیچ کتابی نمیتواند به شما بگوید که pH مناسب چیست. تنها چیزی که به شما کمک میکند، نیمه عمر آن سم میباشد و این تنها یک قسمت ماجرا است.
در هر صورت پس از اینکه قلیا دوست بودن یا اسید دوست بودن آن مشخص شده میتوانید از اصلاح کننده استفاده کنید. اگر pH لازم برای سم شما اسیدی بود میتوانید از کاهش دهندههای pH موجود در بازار استفاده کنید که انواع زیادی دارند:
- خانواده سولفات کاربامید
- خانواده فسفا کاربامید
- خانواده اسیدهای آلی
- خانواده سولفاماتها
هر کدام از این خانوادهها دارای مزایا و معایب خاص خود میباشند که بایستی با توجه به آن انتخاب و مصرف شوند.
جدول مناسبترین pH آب سمپاشی برای یکسری از سموم مختلف
| ردیف | نام سم | مناسبترین pH آب برای سمپاشی |
|---|---|---|
| 1 | بنومیل | 5 |
| 2 | کاپتان | 5 |
| 3 | مانکوزب | 6 |
| 4 | گلایفوزیت | 5-6 |
| 5 | تو فور دی | 4.5-7 |
| 6 | مالاتیون | 5 |
| 7 | استامی پراید | 6-7 |
| 8 | ایندوسکارپ | 5 |
| 9 | کلرپریفوس | 5 |
| 10 | پرمترین | 6 |
| 11 | آبامکتین | 6-7 |
| 12 | ایمیدوکلوپراید | 7.5 |
| 13 | دی متوات | 6 |
| 14 | پروپارژیت | کمتر از 7 |
| 15 | دیازینون | 7-8 |
| 16 | فوزالن | 6 |
| 17 | ریدومیل | 5-9 |
| 18 | پروپیکونازول | 5-9 |
| 19 | هالوکسی فوپ ارمتیل | 4-5 |
| 20 | کلوینافوپ پروپارژیل | 5 |
| 21 | تری بنورون متیل | 8 |